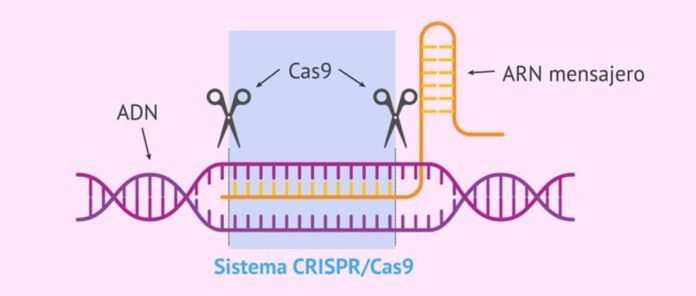
Bakteerien ja virusten "CRISPR-Cas-järjestelmät" tunnistavat ja tuhoavat tunkeutuvia virussekvenssejä. Se on bakteeri- ja arkeaalinen immuunijärjestelmä, joka suojaa virusinfektioita vastaan. Vuonna 2012 CRISPR-Cas-järjestelmä tunnustettiin a genomin muokkaustyökalu. Siitä lähtien on kehitetty laaja valikoima CRISPR-Cas-järjestelmiä, ja niille on löydetty sovelluksia muun muassa geeniterapiassa, diagnostiikassa, tutkimuksessa ja sadon parantamisessa. Tällä hetkellä saatavilla olevilla CRISPR-Cas-järjestelmillä on kuitenkin rajallinen kliininen käyttö johtuen usein esiintyvistä kohteen ulkopuolisista muokkauksista, odottamattomista DNA-mutaatioista ja perinnöllisistä ongelmista. Tutkijat ovat hiljattain raportoineet uudesta CRISPR-Cas-järjestelmästä, joka voi kohdistaa ja tuhota mRNA:n ja proteiinit liittyvät eri geneettisiin sairauksiin tarkemmin ilman kohdevaikutuksia ja perinnöllisiä ongelmia. Craspase-niminen se on ensimmäinen CRISPR-Cas-järjestelmä, joka näkyy proteiini muokkaustoiminto. Se on myös ensimmäinen järjestelmä, joka voi muokata sekä RNA:ta että proteiini. Koska Craspase voittaa monet olemassa olevien CRISPR-Cas-järjestelmien rajoitukset, sillä on potentiaalia mullistaa geeniterapia, diagnostiikka ja seuranta, biolääketieteellinen tutkimus ja sadon parantaminen.
"CRISPR-Cas-järjestelmä" on bakteerien ja arkkien luonnollinen immuunijärjestelmä virusinfektioita vastaan, joka tunnistaa, sitoo ja hajottaa virusgeenin sekvenssit suojatakseen. Se koostuu kahdesta osasta – bakteeri-RNA:sta, joka on transkriptoitu virusgeenistä, joka on sisällytetty bakteerigenomiin ensimmäisen tartunnan jälkeen (nimeltään CRISPR, joka tunnistaa tunkeutuvien virusgeenien kohdesekvenssit) ja siihen liittyvästä tuhoajasta. proteiini nimeltään "CRISPR liittyy proteiini (Cas)”, joka sitoo ja hajottaa tunnistetut sekvenssit virusgeenissä suojellakseen bakteereita viruksilta.
CRISPER tarkoittaa "klusteroitua säännöllisesti välimatkan päässä lyhyitä palindromisia toistoja". Se on transkriptoitua bakteeri-RNA:ta, jolle on tunnusomaista palindromiset toistot.
Palindromiset toistot (CRISPR:t) löydettiin ensin sekvensseistä E. coli Vuonna 1987 Francisco Mojica havaitsi samanlaisia rakenteita arkeissa, ja hän ajatteli niitä ensimmäisenä osana bakteerien ja arkeiden immuunijärjestelmää. Vuonna 1995 osoitettiin kokeellisesti ensimmäistä kertaa, että bakteerien ja arkkien immuunijärjestelmän kohteena oli vieras DNA, ei mRNA. Virussekvenssien tunnistamis- ja hajoamismekanismi ehdotti, että tällaisia järjestelmiä voitaisiin käyttää työkaluna genomin muokkaus. Sen jälkeen kun CRISPR-Cas-järjestelmä tunnustettiin genomin muokkaustyökaluksi vuonna 2012, se on kulkenut hyvin pitkän tien vakaana standardina. geeninkäsittely järjestelmä ja on löytänyt laajan valikoiman sovelluksia biolääketieteessä, maataloudessa ja lääketeollisuudessa, mukaan lukien kliininen geeniterapia1,2.
Laaja valikoima CRISPR-Cas-järjestelmät on jo tunnistettu ja saatavilla DNA/RNA-sekvenssien seurantaan ja muokkaamiseen tutkimusta, lääkeseulontaa, diagnostiikkaa ja hoitoa varten. Nykyiset CRISPR/Cas-järjestelmät on jaettu kahteen luokkaan (luokka 2 ja 1) ja kuuteen tyyppiin (tyyppi I–XI). Luokan 2 järjestelmissä on useita Cas proteiinit joiden on muodostettava toiminnallinen kompleksi sitoutuakseen kohteisiinsa ja toimiakseen niiden mukaisesti. Toisaalta luokan 2 järjestelmissä on vain yksi suuri Cas proteiini kohdesekvenssien sitomiseen ja hajottamiseen, mikä tekee luokan 2 järjestelmien käytöstä helpompia. Yleisesti käytetyt luokan 2 järjestelmät ovat Cas 9 Type II, Cas13 Type VI ja Cas12 Type V. Näillä järjestelmillä voi olla ei-toivottuja sivuvaikutuksia eli kohteen ulkopuolisia vaikutuksia ja sytotoksisuutta.3,5.
Geeniterapiat Nykyisiin CRISPR-Cas-järjestelmiin perustuvilla järjestelmillä on rajoitettu kliininen käyttö, koska usein esiintyy kohteen ulkopuolista muokkausta, odottamattomia DNA-mutaatioita, mukaan lukien suuret DNA-fragmenttien deleetiot ja suuret DNA-rakennemuunnelmat sekä kohde- että kohteen ulkopuolisissa kohdissa, mikä johtaa solukuolemiin. ja muita perinnöllisiä ongelmia.
Craspase (tai CRISPR-ohjattu kaspaasi)
Tutkijat ovat hiljattain raportoineet uudesta CRISPER-Cas-järjestelmästä, joka on luokan 2 tyypin III-E Cas7-11-järjestelmä, joka liittyy kaspaasin kaltaiseen proteiini tästä syystä nimetty Craspase tai CRISPR-ohjattu kaspaasi 5 (Kaspaasit ovat kysteiiniproteaaseja, joilla on keskeinen rooli apoptoosissa solurakenteiden hajoamisessa). Sillä on potentiaalisia sovelluksia esimerkiksi geeniterapiassa ja diagnostiikassa. Craspase on RNA-ohjattu ja RNA-kohdennettu, eikä se ole mukana DNA-sekvensseissä. Se voi kohdistaa ja tuhota mRNA:n ja proteiinit liittyvät eri geneettisiin sairauksiin tarkemmin ilman tavoitteen ulkopuolista vaikutusta. Siten sairauksiin liittyvien geenien eliminointi on mahdollista pilkkomalla mRNA- tai proteiinitasolla. Myös Craspasea voidaan käyttää tiettyyn entsyymiin yhdistettynä proteiinien toimintojen muokkaamiseen. Kun sen RNaasi- ja proteaasitoiminnot poistetaan, Craspase deaktivoituu (dCraspase). Sillä ei ole leikkaustoimintoa, mutta se sitoutuu RNA- ja proteiinisekvensseihin. Siksi dCraspasea voidaan käyttää diagnostiikassa ja kuvantamisessa sairauksien tai virusten seurantaan ja diagnosointiin.
Craspase on ensimmäinen CRISPR-Cas-järjestelmä, joka näyttää proteiinien muokkaustoiminnon. Se on myös ensimmäinen järjestelmä, joka pystyy muokkaamaan sekä RNA:ta että proteiinia. Sen geeninkäsittely Toiminnolla on minimaaliset off-kohdevaikutukset eikä periytyviä ongelmia. Näin ollen Craspase on todennäköisesti turvallisempi kliinisessä käytössä ja terapiassa kuin muut tällä hetkellä saatavilla olevat CRISPR-Cas-järjestelmät 4,5.
Koska Craspase voittaa monet olemassa olevien CRISPR-Cas-järjestelmien rajoitukset, sillä on potentiaalia mullistaa geeniterapia, diagnostiikka ja seuranta, biolääketieteellinen tutkimus ja sadon parantaminen. Lisää tutkimusta tarvitaan luotettavan annostelujärjestelmän kehittämiseksi, joka kohdistaa tarkasti sairautta aiheuttavat geenit soluissa ennen turvallisuuden ja tehokkuuden osoittamista kliinisissä kokeissa.
***
Viitteet:
- Gostimskaya, I. CRISPR-Cas9: Historia sen löytämisestä ja eettisiä näkökohtia sen käytöstä genomin muokkauksessa. Biochemistry Moscow 87, 777–788 (2022). https://doi.org/10.1134/S0006297922080090
- Chao Li et ai 2022. Laskennalliset työkalut ja resurssit CRISPR/Casin genomieditointiin. Genomiikka, proteomiikka ja bioinformatiikka. Saatavilla verkossa 24. maaliskuuta 2022. DOI: https://doi.org/10.1016/j.gpb.2022.02.006
- van Beljouw, SPB, Sanders, J., Rodríguez-Molina, A. et ai. RNA-kohdistavat CRISPR-Cas-järjestelmät. Nat Rev Microbiol 21, 21-34 (2023). https://doi.org/10.1038/s41579-022-00793-y
- Chunyi Hu et ai 2022. Craspase on CRISPR RNA -ohjattu, RNA-aktivoitu proteaasi. Tiede. 25. elokuuta 2022. Osa 377, numero 6612. s. 1278-1285. DOI: https://doi.org/10.1126/science.add5064
- Huo, G., Shepherd, J. & Pan, X. Craspase: Uusi CRISPR/Cas-kaksoisgeenieditori. Functional & Integrative Genomics 23, 98 (2023). Julkaistu: 23. maaliskuuta 2023. DOI: https://doi.org/10.1007/s10142-023-01024-0
***